
Formulación y Nomenclatura Inorgánica I
En nuestra sociedad, existen miles de sustancias químicas diferentes, ya sean sustancias existentes en la naturaleza o sustancias sintetizadas artificialmente por el ser humano. Ante tal cantidad de sustancias diferentes, surgió la necesidad de crear una serie de reglas para poder identificarlas. De esta manera, se creó un organismo científico internacional, IUPAC, con el objetivo de constituir una serie de reglas para asignar a cada sustancia un nombre y una fórmula que las identifiquen.
A lo largo de estos posts, vamos a estudiar la formulación y nomenclatura de las sustancias inorgánicas, es decir, aquellas en cuya estructura no existen cadenas de átomos de carbono ramificadas.
Pero antes de aprender a formular y nombrar, hemos de aprender lo que se denominan valencias de los elementos.
VALENCIAS DE LOS ELEMENTOS
Las valencias son unos números enteros asociados a diferentes elementos que determinan en qué proporción se van a combinar estos para formar los compuestos químicos. Estas valencias, pueden ser números positivos o negativos y además cada elemento puede tener una o más valencias.
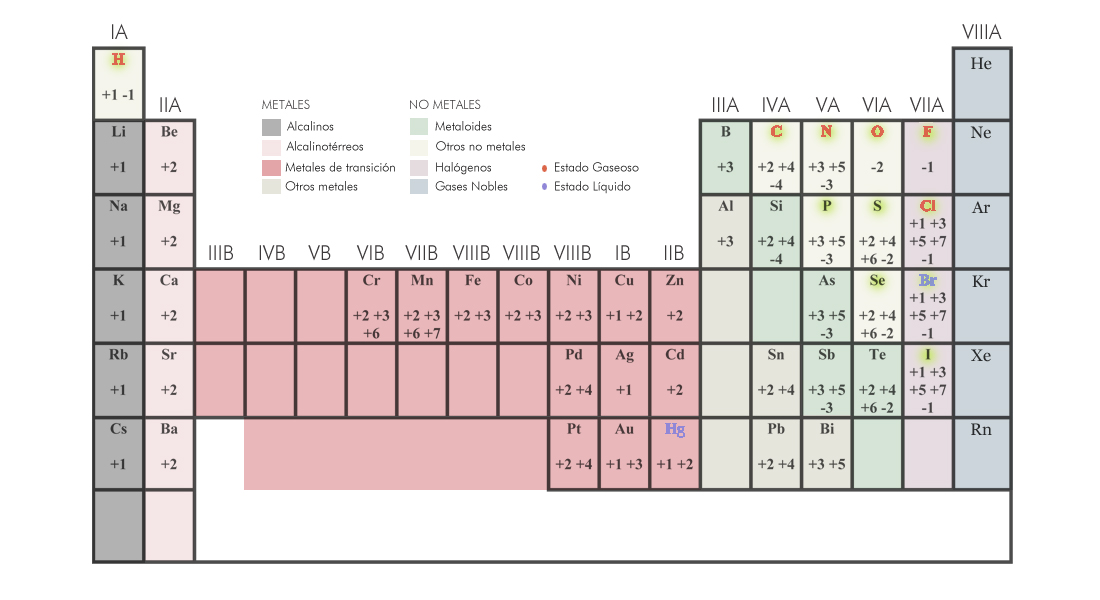
Las valencias de los principales elementos químicos, las cuales debemos conocer para poder formular y nombrar compuestos químicos, se encuentran en la siguiente tabla periódica:
SUSTANCIAS SIMPLES
Son sustancias químicas que están formadas por un solo tipo de elemento.
- FORMULACIÓN DE SUSTANCIAS SIMPLES
En la formulación de estas sustancias, puede aparecer un subíndice o no. Este subíndice indica el número de átomos que hay de ese elemento en dicha molécula.
Las fórmulas de las sustancias simples formadas por átomos de gases nobles, metales y algunos no metales como el C y Si no llevan ningún subíndice en la fórmula. Ejemplos: Cu, Sn, Au, Ar, Kr, C, Si…
El resto de no metales no indicados en el apartado anterior presentan subíndices en la fórmula, esto quiere decir que las moléculas de estas sustancias simples tienen más de un átomo del elemento por el que están formadas, como por ejemplo:
- Sustancias simples no metálicas cuyo subíndice es 2: H2, N2, O2, F2, Cl2, Br2, I2
- Sustancias simples no metálicas cuyo subíndice es 3: O3
- Sustancias simples no metálicas cuyo subíndice es 4: P4, As4
- Sustancias simples no metálicas cuyo subíndice es 8: S8, Se
- NOMENCLATURA DE SUSTANCIAS SIMPLES
Las sustancias simples se pueden nombrar de dos formas diferentes: con nomenclatura tradicional y con nomenclatura sistemática.
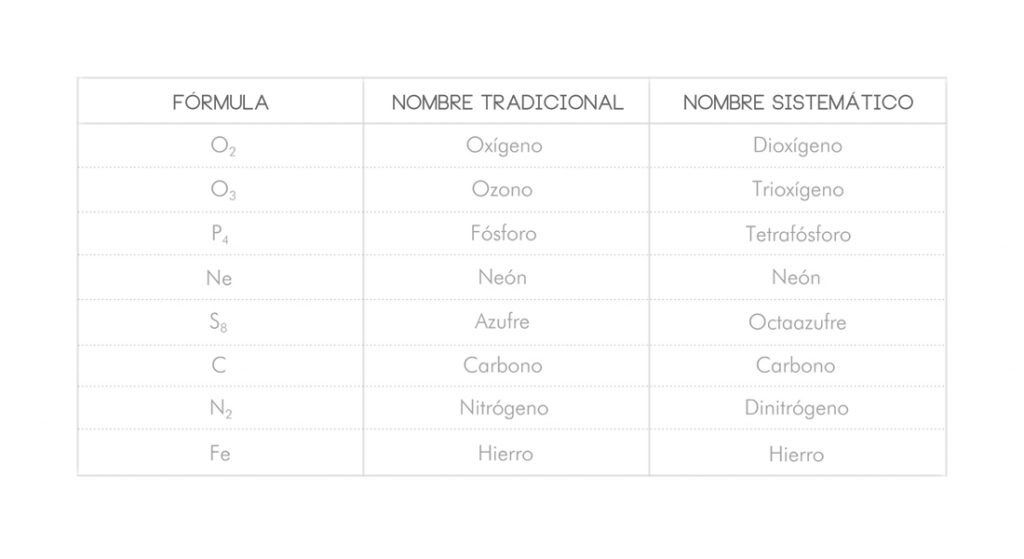
La nomenclatura tradicional consiste en nombrar la sustancia simple sólo con el nombre del elemento. La única excepción es la de la especie O3 que recibe el nombre de ozono.
La nomenclatura sistemática consiste en anteponer al nombre del elemento un prefijo numeral que indica el número de átomos que hay de esa sustancia (di-, tri-, tetra-, penta-, hexa-, hepta-, octa-). Estos prefijos numerales se utilizarán para indicar el número de átomos en la nomenclatura de cualquier elemento en todos los tipos de compuestos.
Vamos a ver algunos ejemplos de cómo se nombran este tipo de sustancias en ambas nomenclaturas:


Bablofil
7 enero, 2017 at 8:09 amThanks, great article.